산화 스트레스와 알츠하이머
산화 스트레스(oxidative stress)는 산화된 성분 물질의 증가로 일어나는 다단계 반응이다.산화 스트레스는 생체 내에서 효소촉매반응, 미토콘드리아 내 전자전달, 세포 신호 전달계와 유전자발현, 전사인자의 활성화 및 생체 분자, 세포, 조직에 대한 산화적 손상을 통해 노화 및 거의 모든 질병의 원인으로 작용하는 것으로 알려져 있다.
산화 과정은 세포가 에너지를 생산하는 과정에서 산소를 이용할 때 발생한다. 예를 들어 세포호흡 과정에서 포도당이 산소와 반응하여 이산화탄소와 물으로 분해되는 과정이 있다. 이러한 산화 과정에서 비정상적인 수의 전자를 가져 매우 불안정한 활성산소종(ROS)이 발생한다. 활성산소종은 다른 자유 전자와 반응성이 높아 생체 분자의 안정성 및 활성에 영향을 미친다. 활성산소종의 발생은 정상적이며 건강을 위해 어느 정도 필요하나, 그 양이 손상 복구를 위해 요구되는 양을 넘어설 경우 산화 스트레스가 발생한다. 즉, 세포 또는 조직 내 항산화제와 산화제 간 균형이 깨져 발생하는 생체 현상이 산화 스트레스인 것이다.
알츠하이머병은 아밀로이드 베타 단백질, 타우 단백질 등 이상 단백질이 뇌에 쌓이면서 신경세포가 서서히 죽어 가는 퇴행성 신경 질환이다. 알츠하이머병과 연관된 생체 반응이 매우 많아 아직 병의 명확한 원인은 밝혀지지 않았으나, 가장 우세한 가설이 아밀로이드 베타 단백질이 뇌에서 뭉쳐 발생한다는 것이다. 산화 스트레스와 철, 아연, 구리와 같은 금속 이온들는 이 뭉침 현상의 조절인자로 작용하게 된다. 뿐만 아니라, 구리와 같이 산화-환원 작용이 활발한 금속 이온과 함께 뭉쳐진 아밀로이드 단백질 응집체는 아밀로이드 베타 펩타이드 그 자체와 주변 생체 분자에 유해한 활성산소종을 생성한다.
활성산소종의 일종인 수산화 라디칼은 모든 염기와 deoxyribose 구조를 포함하는 DNA의 모든 성분에 산화적 손상을 일으킬 수 있다. 이러한 손상은 DNA의 영구적 변형을 일으킬 수 있고, 나아가 돌연변이, 발암, 그리고 노화를 일으킨다. 수산화 라디칼에 의한 DNA와 RNA의 산화는 8-hydroxyguanosine(8OHG)를 표시물질로 사용하여 검출할 수 있다. 8OHG의 증가는 신경세포체의 세포질내에서 발견되고, 이는 알츠하이머병의 특징 병변인 신경원섬유 매듭과 관련이 있다.
산화 스트레스는 과도할 경우 돌연변이, 발암, 노화 등 다양한 질병을 일으키지만, 소량의 산화 스트레스는 산화촉진제와 항산화제 사이 균형을 포함한 항상성을 유지하는 신체의 항산화 시스템을 조정한다. 항산화제는 활성산소종으로 인한 손상을 방어하기 위해 서로 협력하며, superoxide dismutase(SOD), catalase(CAT), glutathione peroxidase, glutathione-S- transferase와 같은 항산화 효소와 멜라토닌, 카로티노이드, 그리고 몇몇 미량원소 같은 비효소 항산화 요인으로 나눌 수 있다.
항산화 효소는 보통 비효소적 항산화 요인과 협력하여 기능한다. 보통 구리, 아연, 망간 등의 금속 원소인 이 협력 요소들을 보조인자라 하는데, 항산화 효소는 보조인자와 결합하여 효소 복합체를 형성한다.
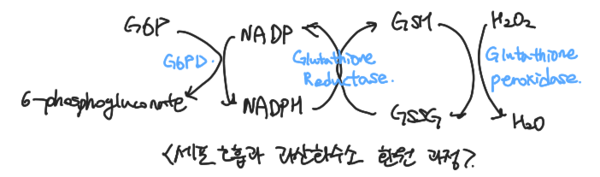
대표적인 항산화 효소인 SOD는 가장 강력한 효소이며, 활성 산소와 만나면 전자를 받아 환원되면서 과산화소소가 된다. 이후 과산화수소는 카달라아제와 글루타치온과 반응해 환원되어 물로 변환되어 몸 밖으로 배출된다. 과산화수소를 제거하는 글루타치온은 또한 항산화 효소의 한 종류로, 체내에서 산화형 GSSG, 환원형 GSH 두 가지 형태로 존재한다. GSSG는 GR을 통해 NADH를 NAD+로 산화시키고, GSH는 다시 산화되면서 과산화수소를 제거한다. 이 효소는 NADH를 매개로 하기에 세포 호흡의 산화 환원 반응과도 연관되어 반응한다.